√完了しました! 原子記号 質量数 152947-原子記号 質量数
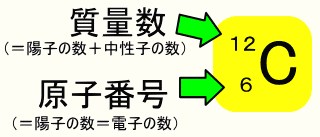
質量数(しつりょうすう、英語 mass number )とは、核種を区別する量の一つで、原子核を構成する核子の個数、すなわち陽子と中性子の個数の合計である 。 通常は記号 A で表される。 同位体を区別するときに用いられることが多く 、元素記号の左肩に示す。 。たとえば、質量数12の炭素©₂₀₁₅日本化学会 原子量専門委員会 原 子 量 表 (₂₀₁₅) (元素の原子量は,質量数₁₂の炭素( 12c)を₁₂とし,これに対する相対値とする。但し,この 12cは核および電子が基底状態にある結合してい ない中性原子を示す。原子 物質を 構成 している最小

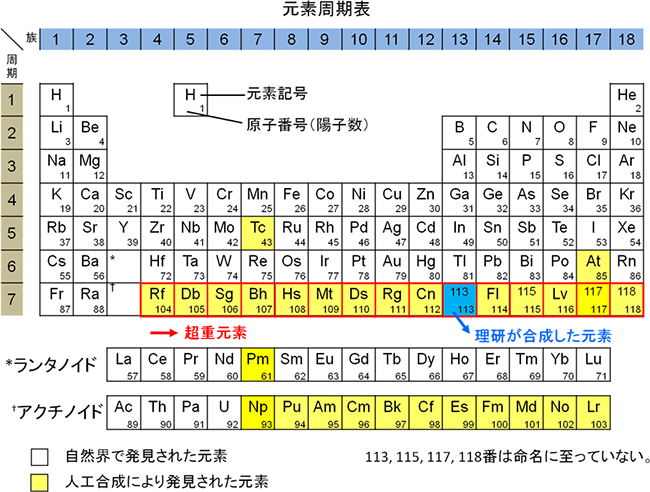
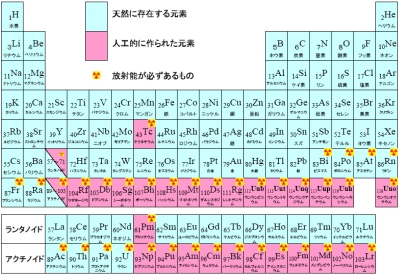
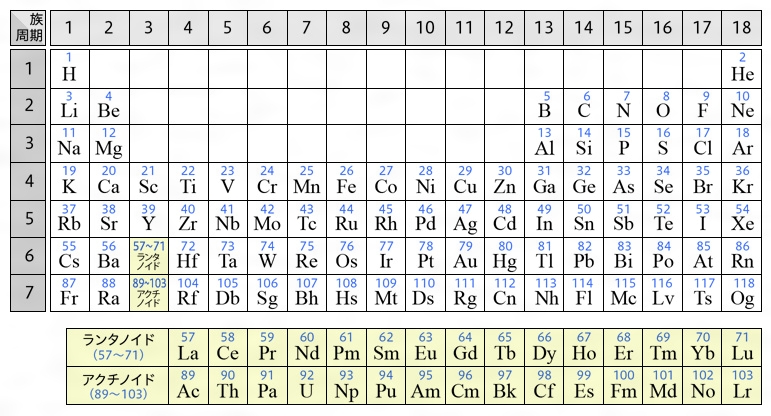
元素周期表 元素周期律表 自然元素と人工元素 Arealink
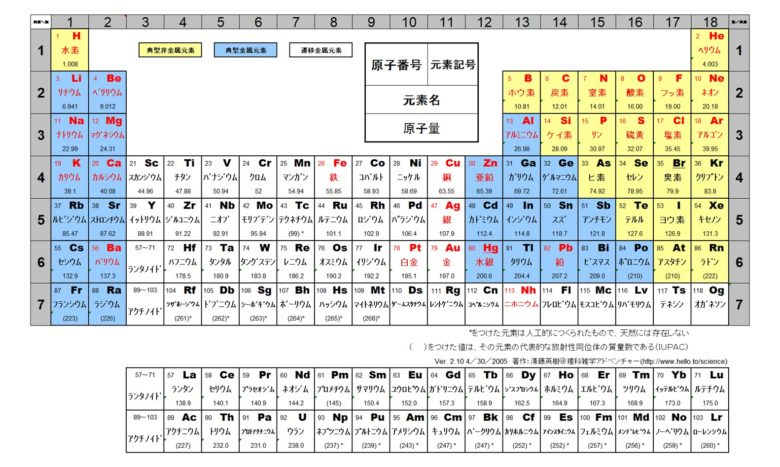
原子記号 質量数
原子記号 質量数- 原子番号や質量数を付記する際の書き方 原子番号や質量数を付記する場合、原子番号は左下に (13 Al)、質量数は左上に (27 Al) 、イオン価は右肩に (Al 3)、原子数は右下に (N 2) 付記す 原子量と質量数のクイックレビュー 06 Aug, 19 原子量と原子質量数は、化学における2つの重要な概念です。 ここでは、原子質量と原子質量数の意味、および実際の粒子質量が原子番号とどのように関連しているかについて簡単に説明します。



Spring 8 で元素と地球をつなぐ エアロゾル中の鉄 Fe から 元素の循環 を覗く 分子地球化学 Spring 8 Web Site
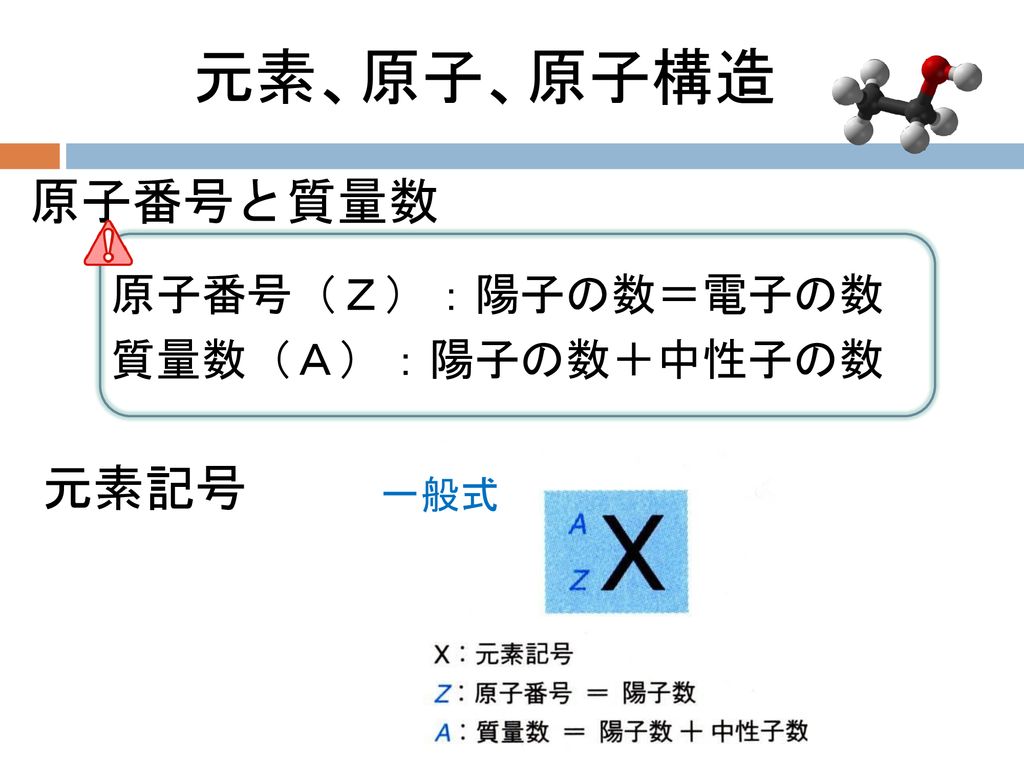
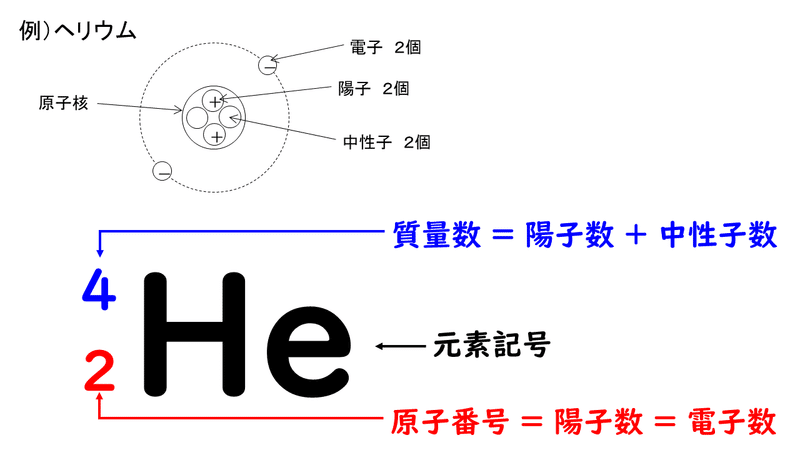
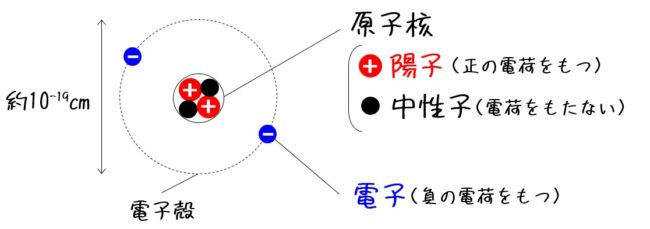
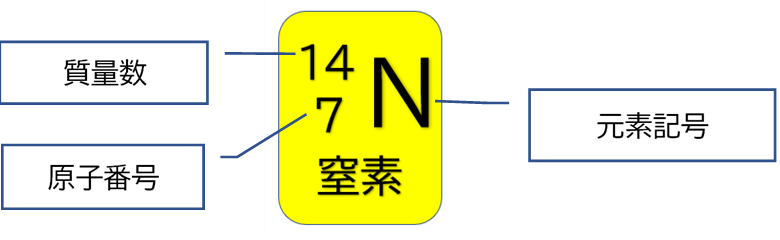
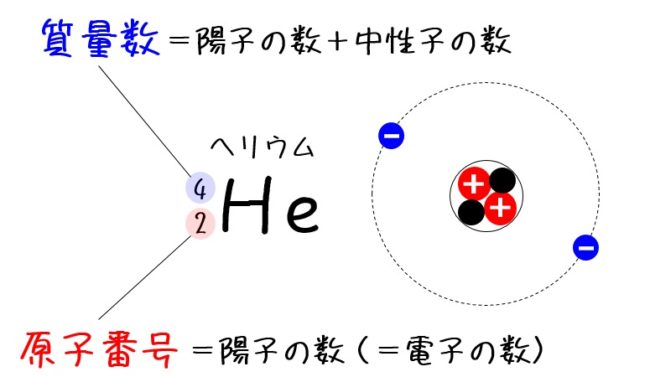
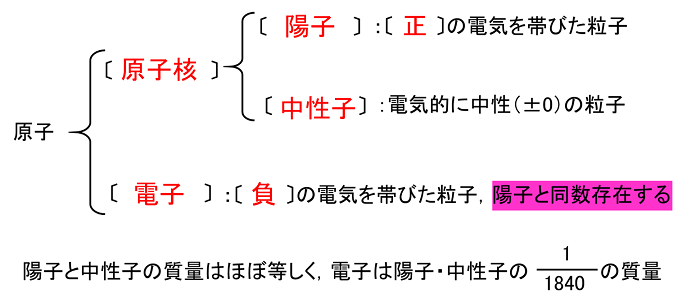
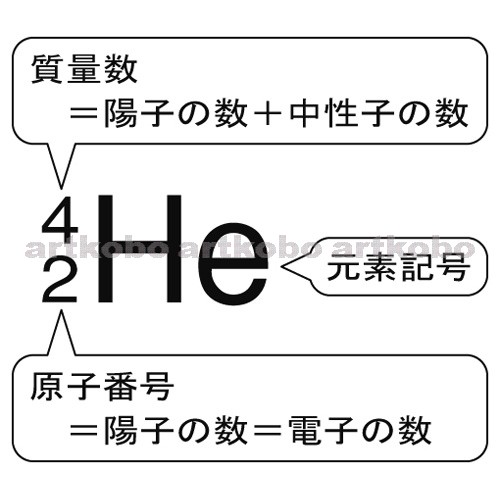
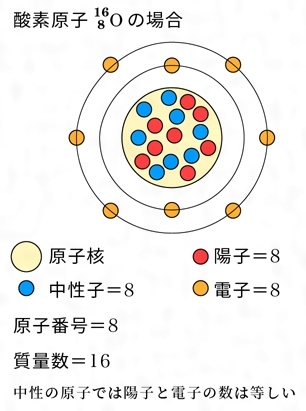
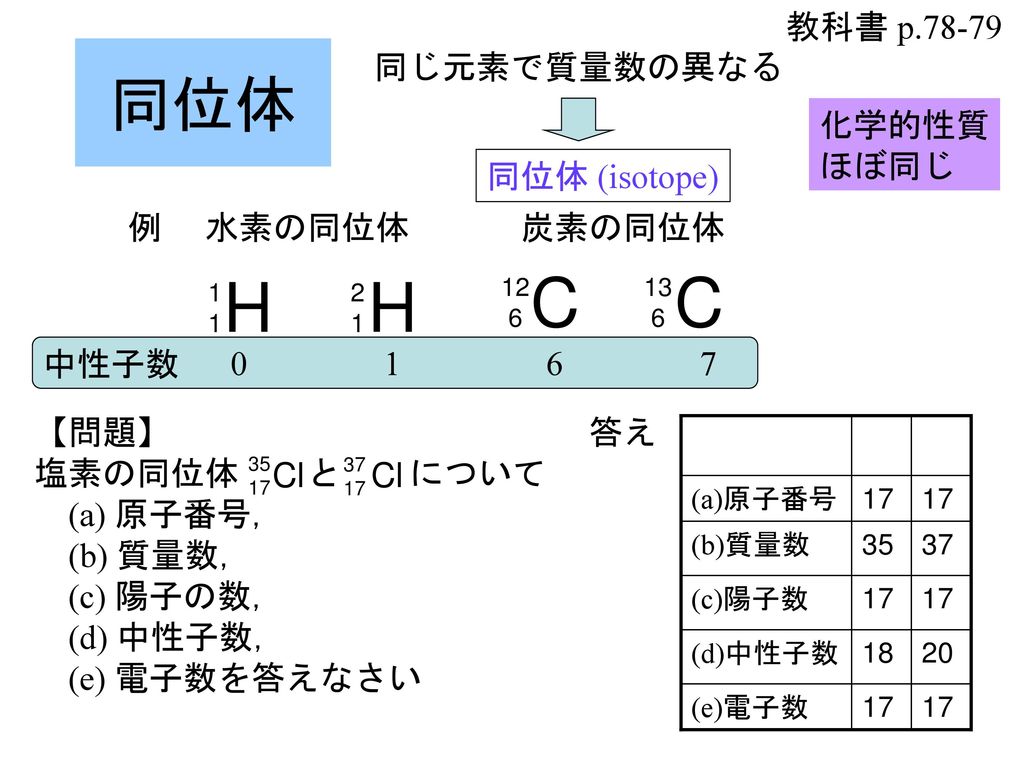
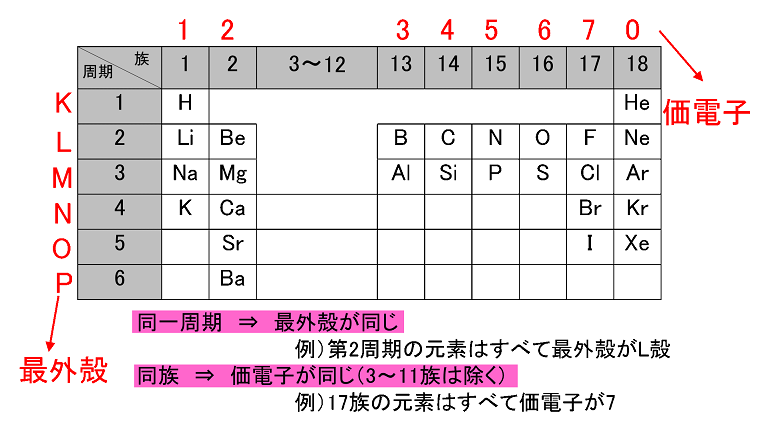
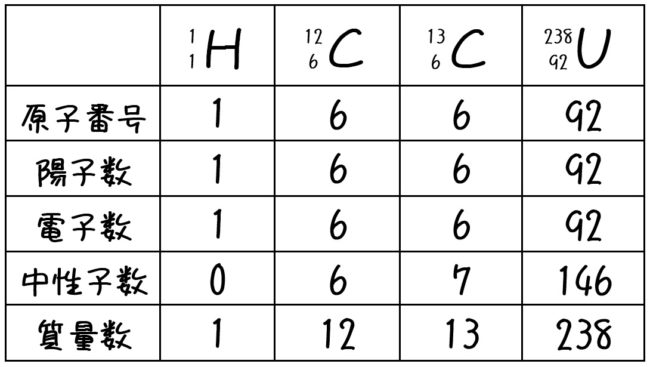
原子番号2He(ヘリウム) 原子は「元素記号」という記号で表わされ、「原子番号」という番号がつけられています。 原子番号=陽子数=電子数 元素は原子の種類をいうときに使い、原子は具体的な粒子をいうときに使います。AとZの組合せの異なる原子核 原子番号:Z、原子記号:X、質量数:A A ZX(または単にAX) 同位体(isotope): Zが同じでAの数の異なる核 種(すなわちNの異なる核種) たとえば、 天然ウラン:質量数が234、235、238 234 92U、235 92U、238 92U電荷を持ちますが、重さは無視できるほど小さく、その質量数は0です。 原子核を構成する陽子の個数をその原子の原子番号zといいます。そして陽子 と中性子の個数の和を質量数aといいます。zとaはそれぞれ元素記号の左下、 左上に添え字で書きます。
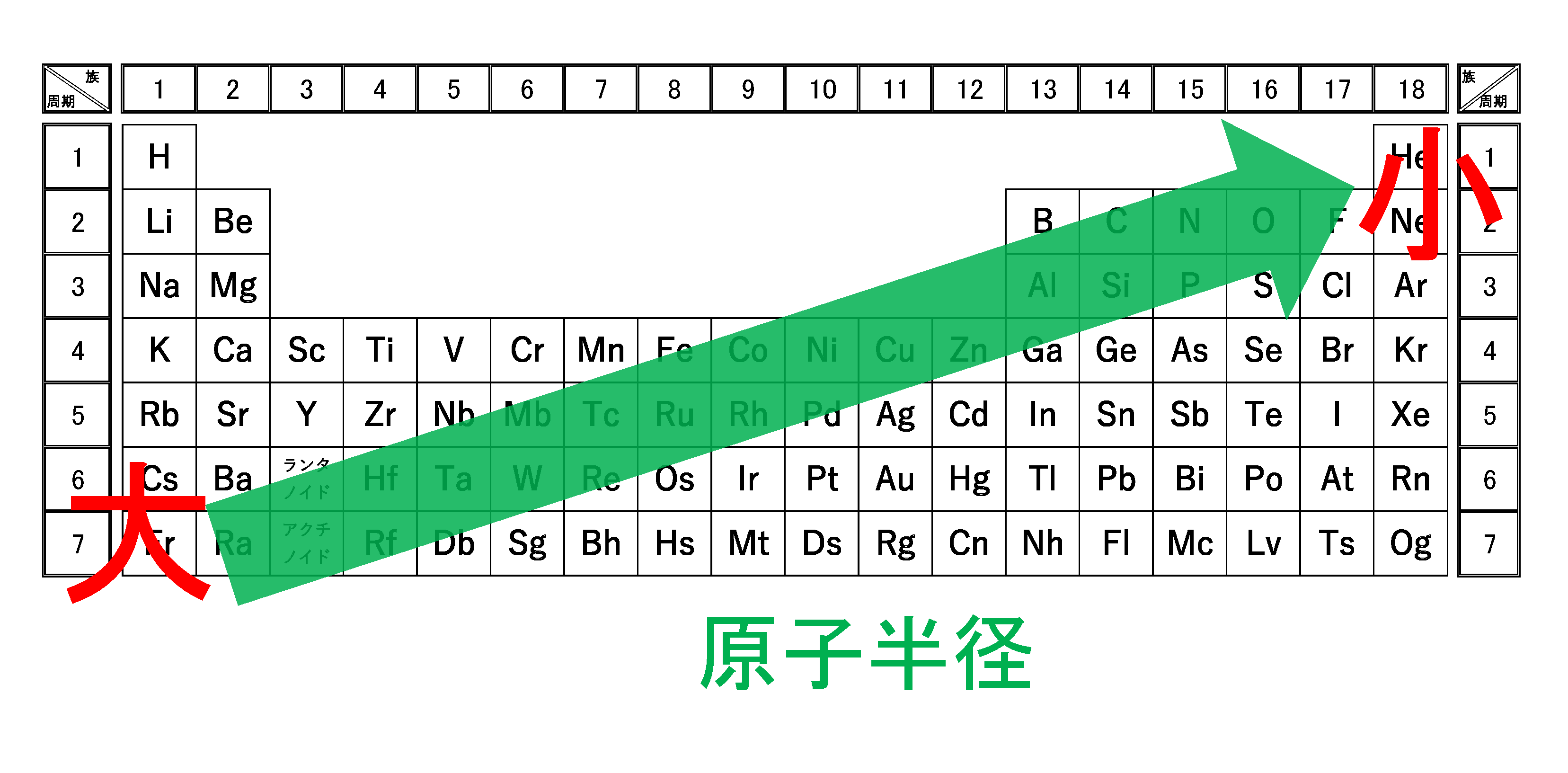
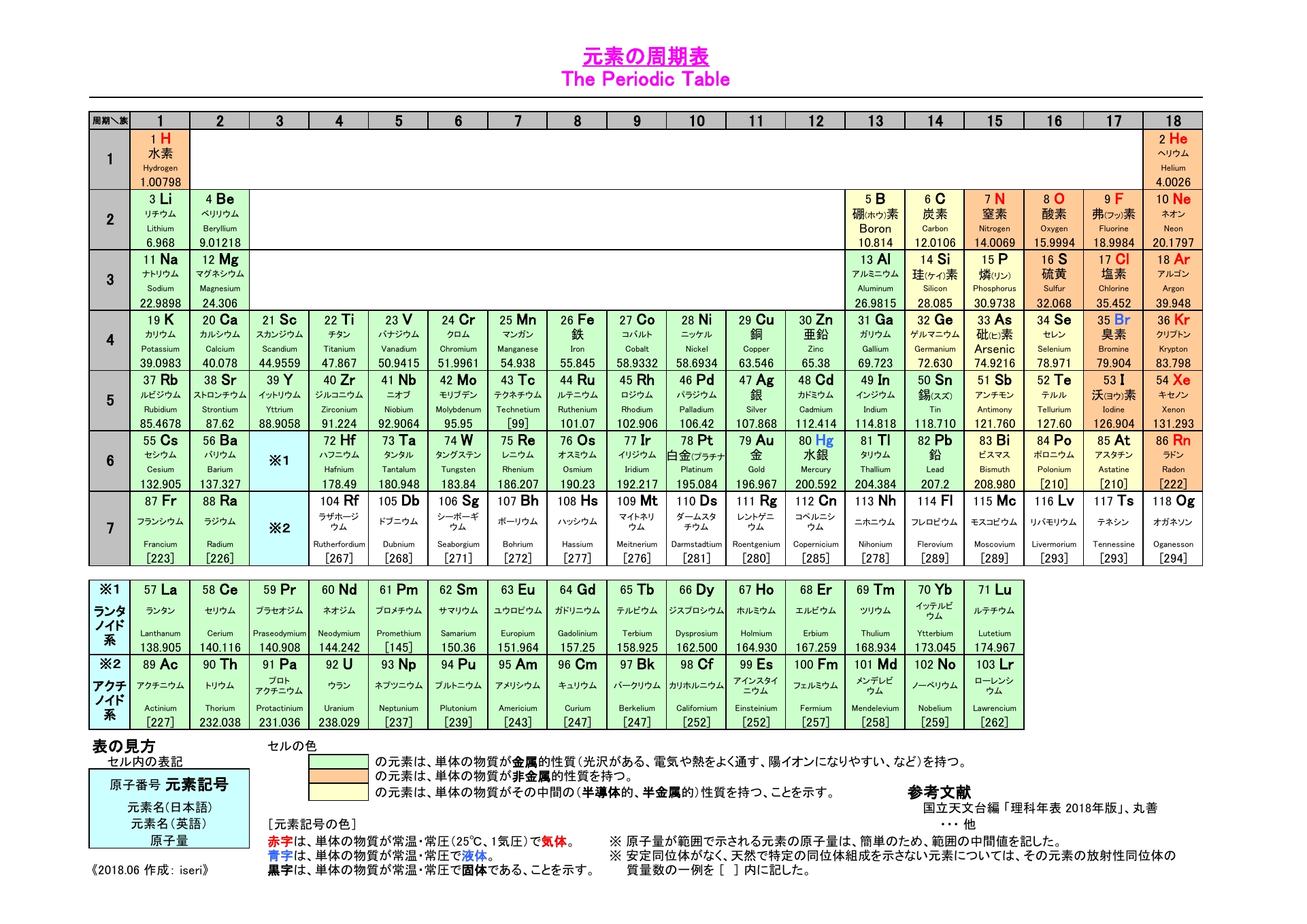
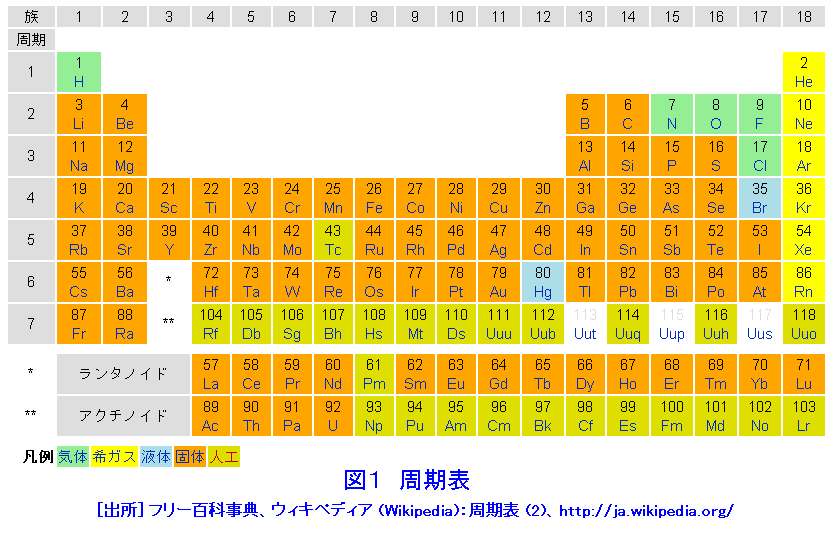
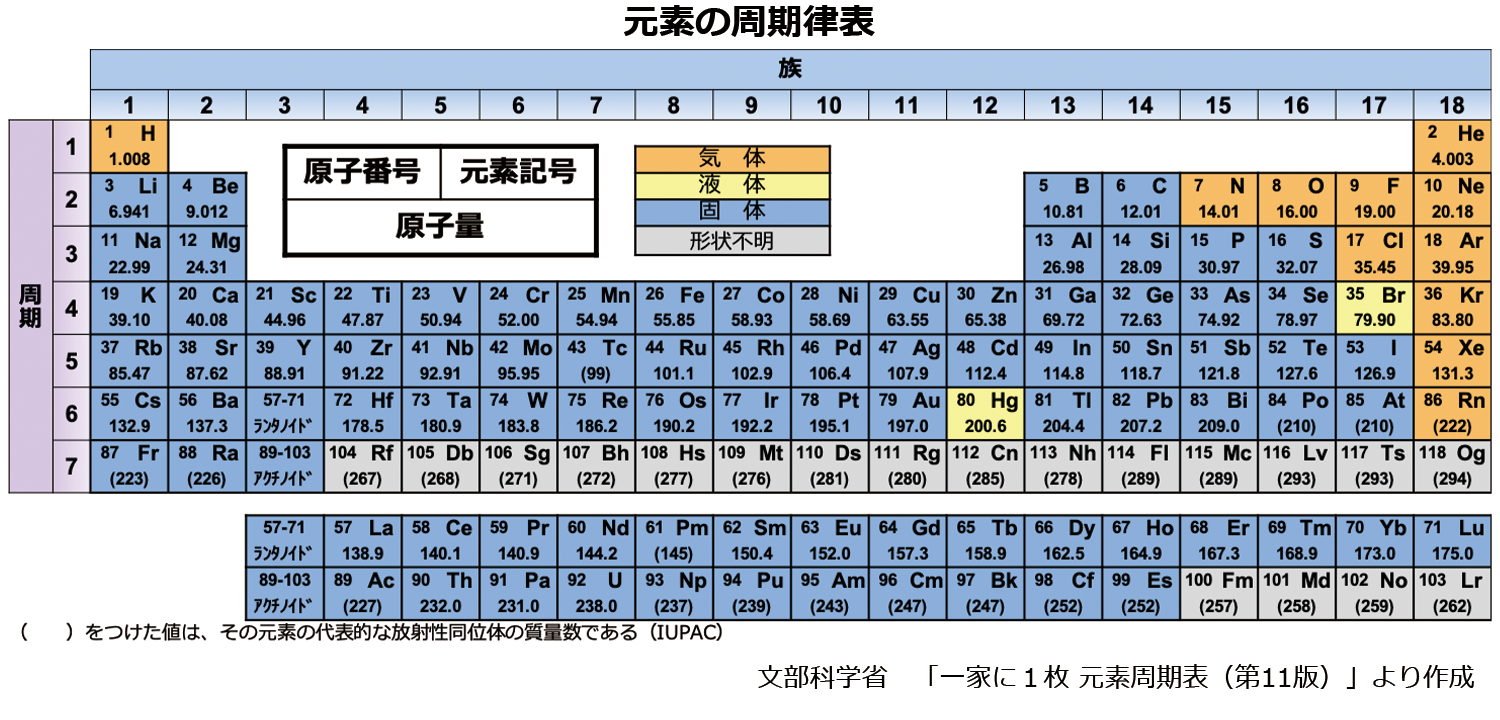
Sym:元素記号。 日本語名:ソートは50音順。 英語名:ソートはアルファベット順。 周期:周期表における周期(横列)。 族:周期表における族(縦列)。ランタノイドは「3L」アクチノイドは「3A」と表示。 原子量(u):原子量と統一原子質量単位(u)。ソートは原子量順。 原子記号は元素記号に質量数と原子番号を書き加えることで成り立っており、 さらには、数学と同じく省略できるものは省略するということで、 太字にしたCについては区別することなく「同じ」という解釈も成り立っていますが、 実際には上記のように2 原子の構造と周期表 15 解答 甥 鴛 原子の大きさは,原子核の大きさにほぼ等しい。× 原子核の大きさ(直径約10 15m=10 6nm)は原 子の大きさ(直径約10 10m=10 1nm)の数万〜 数十万分の1である。 塩 自然界に存在するすべての原子の原子核は,陽子と中 性子とからできている。
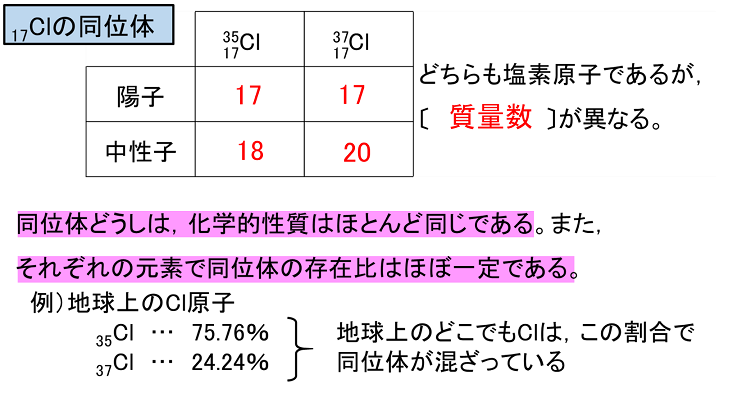
原子番号が同じで質量数が違うものを同位体と言いますが、 これを区別する場合は、一般的には元素名の後に質量数を読みます。 12cならば炭素12(たんそじゅうに)と呼べば伝わるかと思います。 ウランですと、ウラン235とかウラン238と呼びます。アインスタイニウム 元素記号:Es 原子番号:99 同位体の質量数:(252) 亜鉛 元素記号:Zn 原子番号:30 原子量:6538±2 アクチニウム 元素記号:Ac 原子番号: 同位体の質量数:(227) アスタチン 元素記号:At 原子番号:85 同位体の質量数:(210問1 原子番号が 4 で,質量数が9 のベリリウム原子がある。このベリリウム原子の中性子の 数は何個か。 問2 陽子 8 個と中性子8 個をもつ酸素原子がある。この原子を,元素記号に原子番号と質量 数を添えて表せ。 問3 ナトリウム原子 1123




21 See How To Solve It At Qanda




化学基礎 物質の構成16 原子番号と質量数 8分 Youtube
ある特定の原子を表わすときには、元素記号、原子番号、質量数の3つ を用いて下の図のように書きます。原子番号は省略されることもあります。 例えば14nと書いて"窒素14"と読みます。 原子番号と質量数 11 窒素の元素記号 質量数 (核子の数) 原子番号 (陽子の数) 14n 7 自然界には水素からウランま で約90種類もの元素がある陽子の数 + 中性子の数 = 質量数 陽子の数 = 原子番号 4He 元素記号 2きな影響は与えません。従って、原子の質量評価は、ただ原子の陽子と中性子の数を足し合わせればよいの です。その結果をその原子の特有の質量数(mass number)と呼び、記号A で示します。例えば、ナトリウ ム原子は11個の陽子と12個の中性子をその核に持ち



化学反応式の書き方



3
原子番号の55は、その元素によって固有の値だから読む必要がない。 質量数は、中性子の数によって変化するのでこれは読む必要があるということ。 質量数が137のセシウムとそのまんまの意味で読むのもかっこいいね。 次に、表記について。 正解があるのかないのかは知らないけれど 万人の使い方の傾向をみて自分はというと、 元素記号を使用しているときはCs原子質量単位 で表した特定原子核 (または原子)の質量 (または 原子量)にもっとも近い整数.一般に原子核は 核子 (陽子と中性子)からなるが,これらの個々の質量は原子質量単位で1にきわめて近い値であるから, 質量欠損 を考慮してもなお,質量数は核子の数の合計に等しくなる.したがって,質量数は原子核を構成する核子の総数とも定義できる.・「質量数 = 陽子の数 中性子の数」の関係がある。・元素記号の左上に質量数,左下に原子番号を書く。 問1 ;



焦らず進もう 第一種放射線取扱主任者試験 物理学



中2化学 原子と分子 中学理科 ポイントまとめと整理
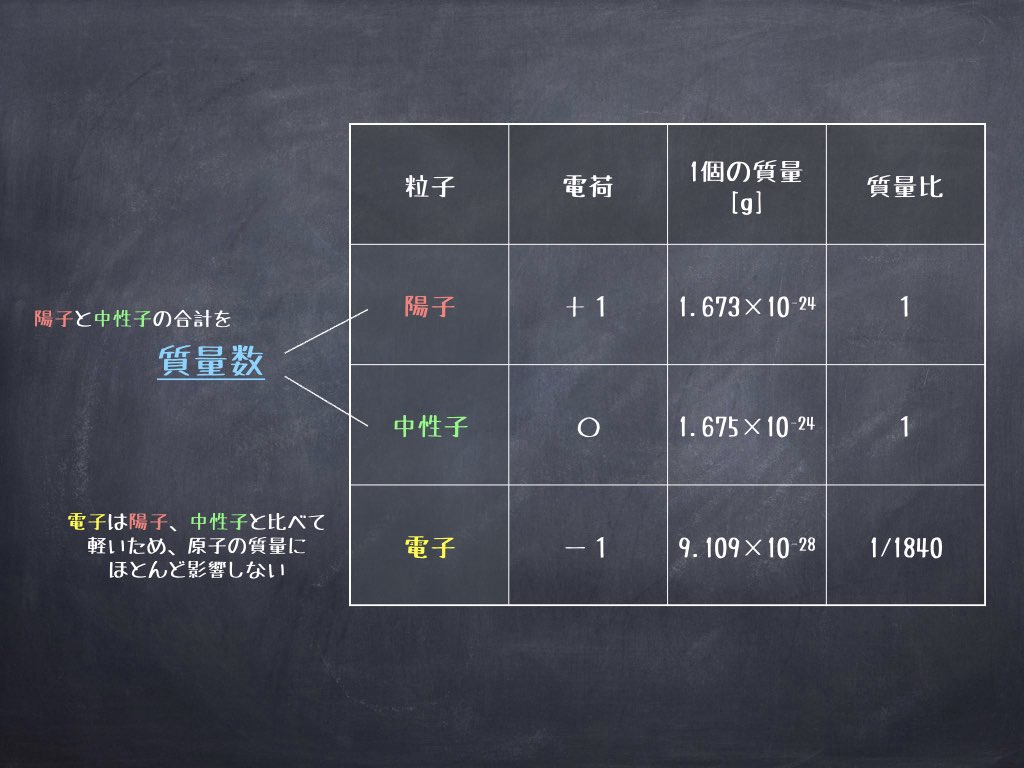
原子の重さを表す質量数は(極端に軽い電子は省くので)陽子の数と中性子の数を足した値となる。 原子の表記法 原子は元素記号という1〜2文字のアルファベットで表される。元素記号の 左上に質量数、左下に原子番号 を書く。 また、陽子と中性子の粒子の和を(⑤ 質量数 )といい、元素記号の左上に添字して表す。 例えば、原子番号8番の酸素原子Oで、質量数が18の場合、電子の数は(⑥ 8 )、陽子の数は(⑦ 8 )、中性子の数は(⑧ 10 )となる。表2 電子,陽子,中性子のデータ. 記号 電気量 質量kg 質量u 質量比 電子 e electron e 10 31 kg 1/13 u 1 陽子 p proton e 10 27 kg u 1615 中性子 n neutron 0 10 27 kg u 1868 同位体 原子番号が同じでも,中性子数が違う原子が存在する.それらを同位体




質量数とは 求め方 みんなが知りたい2つの疑問を解消 高校生向け受験応援メディア 受験のミカタ




気になるワードの使い分け 原子 と 元素 の違いを元塾講師が解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン
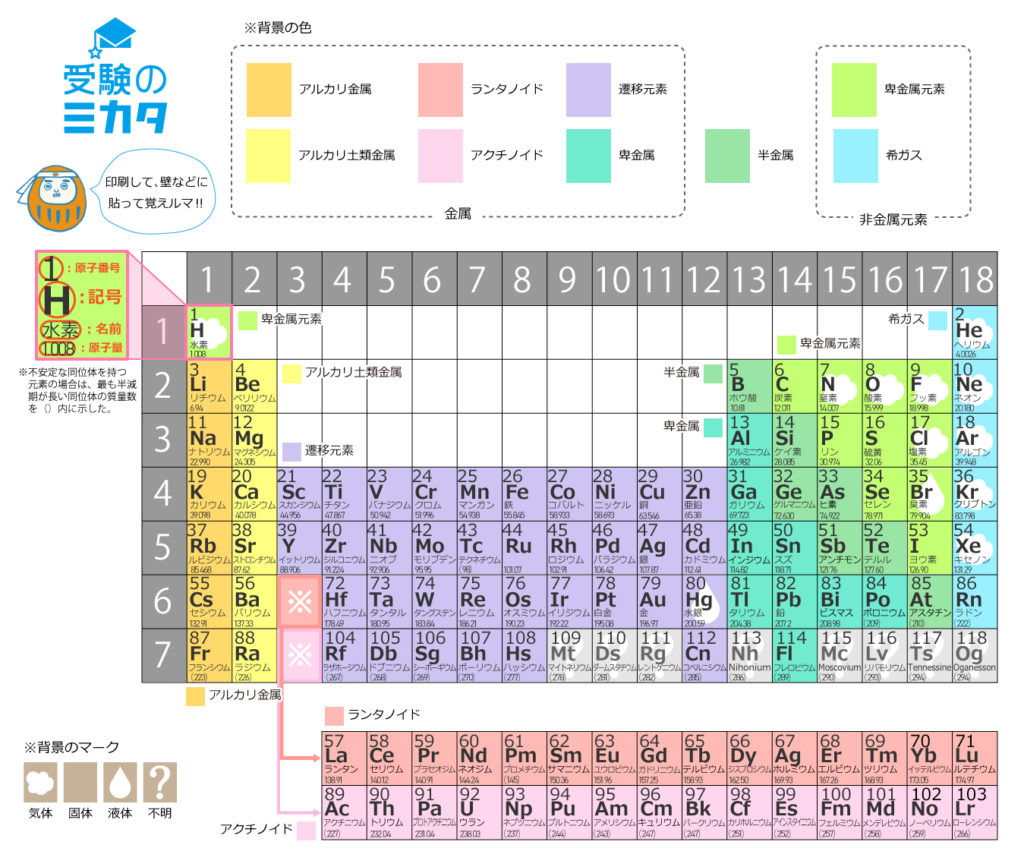
原子核内にある陽子の数を表したのが原子番号である。 原子番号は原子内にある電子の数にも等しい。 原子量 原子の質量を表す数値である。 炭素原子の質量を12として、これを基準にそれに対する比でそれぞれの原子の質量を表したもの。原子番号=陽子の数=電子の数 中性子の数=質量数-原子番号 で求める。 (1) 陽子の数 11,中性子の数 12,電子の数 11 (2) 陽子の数 17,中性子の数 18,電子の数 17原子 番号 元素 英語 記号 原子量 1 水素 Hydrogen H 1008 2 ヘリウム Helium He 4003 3 リチウム Lithium Li 6941 4 ベリリウム Beryllium Be 9012 5 ホウ素 Boron B 1081 6 炭




Images Of 質量数 Japaneseclass Jp



1
問4 質量数とは何か。 (質量数 = 陽子数 + 中性子数) 電子の質量は陽子や中性子に比べて小さいので(無視)できる。 問5 元素記号(原子記号)と原子番号、質量数はどういうふうに表すか。 (省略元素記号(げんそきごう、英語 element symbol )とは、元素、あるいは原子を表記するために用いられる記号のことであり、原子記号(げんしきごう)とも呼ばれる 。 現在は、1、2、ないし3文字のアルファベットが用いられる 。 なお、現在正式な元素記号が決定している最大の元素は原子番 原子番号 原子核中の陽子の数はそれぞれの元素に固有のもので,陽子の数が変われば元素が変わります。 原子番号=陽子の数=(電子の数) 質量数 真ん中の原子核中の 陽子の数+中性子の数 陽子と中性子に比べると、周りをグルグル回っている電子の質量は軽すぎるため無視できます。 元素記号 元素記号は以下の図のようなルールで記述されます。



教養の化学 第3週 13年10月7日 担当 杉本昭子 Ppt Download



Www Meigaku Ac Jp Wp Content Uploads 04 78b5d3e712fb0c0a2cedb65a0384 Pdf
原子記号12Cの陽子数、中性子数、電子数が6 原子記号13Cの陽子数6、中性子数7電子数6 原子質量が1939uとu その後の質量欠損が100uとuになる理由が分かりま せん また、存在比も分かりません 教えてくださいお願いします!質量表示に関連する主な記号 zu 原子質量単位(炭素の同位体13C の場合の使用法: u u)) zAr 相対原子質量を表す記号(炭素の場合の使用法: Ar1107) zMr 相対分子質量(relative molecular mass) を表す記号:分子に使う zMav 平均質量(average mass) を表す記号:イオンの平均質量表示に使う7 87 Fr フランシウム (223) Ra ラジウム (226) –103 7 Ac アクチニウム (227) 90 Th トリウム 234 91 Pa プロトアクチニウム 92 U ウラン



1 2 原子の構造 おのれー Note



化学基礎 原子の構造 原子番号 質量数 Tekibo
原子・元素・分子の違い 質量数と原子番号、同位体について 理論化学 原子・元素・分子って何が違うんだよ~!質量数(しつりょうすう、英語 mass number )とは、核種を区別する量の一つで、原子核を構成する核子の個数、すなわち陽子と中性子の個数の合計である 。 通常は記号 A で表される。 同位体を区別するときに用いられることが多く 、元素記号の左肩に示す。 。たとえば、質量数12の炭素原子核からα粒子(質量数4のHeの原子核)が放出される。 質量数が4つ、原子番号が2つ減少する。 ・β−壊変 中性子過剰核種で起こる。 中性子→




元素周期表 元素周期律表 自然元素と人工元素 Arealink




原子の構成と電子配置 原子番号 電子数 陽子数 質量数 化学 クリボの勉強会 4 Youtube




高校化学基礎 原子番号と質量数 映像授業のtry It トライイット




原子とその構造




同位体とは 同素体との違い 覚え方も早稲田生が紹介 高校生向け受験応援メディア 受験のミカタ




Periodex Chromeアプリ 元素記号や日本語の元素名を確認できる周期表アプリ Chrome拡張のいいところ



元素記号が憶えられない はこれで解決 個別指導のオンライン家庭教師wam



基礎化学1 物質の構成と物質量



Http Www Kyoiku Shuppan Co Jp Textbook Chuu Rika Files Web Syukihyo Pdf



すいません わかる方教えていただいたいですcなどの原子記号の左 Yahoo 知恵袋



113番元素の命名権獲得 理化学研究所




Barmopih Descubre Como Resolverlo En Qanda




美しくも猛毒な水銀 Hg 重いのに俊足な商売の神メルクリウスに由来する元素



原子とその構造



化学基礎 原子の構造 原子番号 質量数 Tekibo




原子の構造 原子番号と質量数の関係 Dr あゆみの物理教室




日本が命名した113番元素 ニホニウム 新元素発見までの道のりとこれから Science Portal 科学技術の最新情報サイト サイエンスポータル



元素記号をおぼえよう をapp Storeで




質量数とは 求め方 みんなが知りたい2つの疑問を解消 高校生向け受験応援メディア 受験のミカタ




周期表暗記のコツは 現役東大生が高校化学で必須の元素の覚え方を語呂合わせで紹介 学びtimes



メディアラボ株式会社 Gperiodic



原子とその構造



Spring 8 で元素と地球をつなぐ エアロゾル中の鉄 Fe から 元素の循環 を覗く 分子地球化学 Spring 8 Web Site



図解版 原子 分子 元素の違いと原子の構造を解説 陽子 中性子 質量数 原子番号 サイエンスストック 高校化学をアニメーションで理解する




L4l C 1 See How To Solve It At Qanda



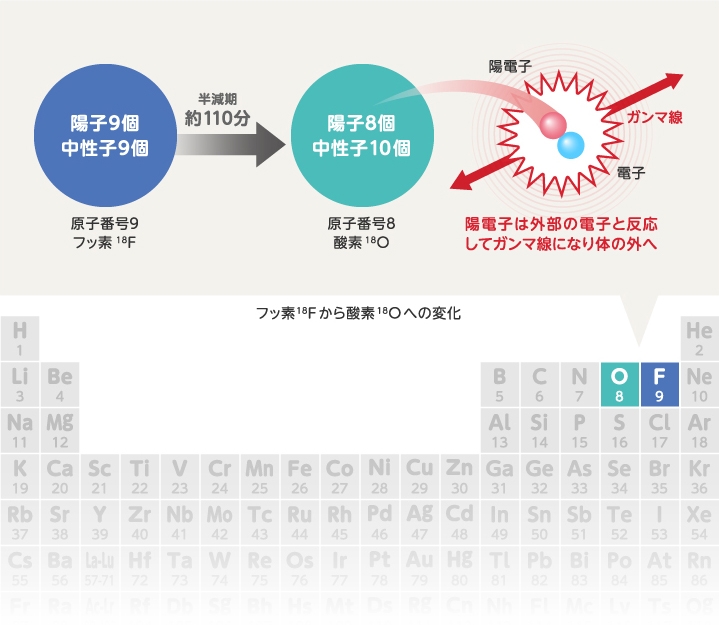
国際周期表年19にちなんで F フッ素 のお話 トピックス ヒカリラボ Photonてらす




元素周期表 見やすい表で覚え方と元素を解説 ゴロ合わせも 高校生向け受験応援メディア 受験のミカタ



質量数 Mass Number Japaneseclass Jp




高校化学基礎 原子番号と質量数 映像授業のtry It トライイット



原子番号 質量数の表記 化学の迷路 ブログ




質量数とは 求め方と原子番号との関係をまとめてみた 化学受験テクニック塾




化学基礎 元素記号 Youtube




第1章 原子と原子核の中身について考えよう 放射線について考えよう



Www Pen Kanagawa Ed Jp Y Meiho H Oshirase Documents 2 Kagakukiso Pdf




元素周期表 見やすい表で覚え方と元素を解説 ゴロ合わせも 高校生向け受験応援メディア 受験のミカタ



元素 一覧 性質




高校化学基礎 原子番号と質量数 映像授業のtry It トライイット




これは 暗記するしかないですか 質量数なのど 暗記してないと書けないですよね Clear



Web教材イラスト図版工房 R Ch 物質の基本構成 09



重元素の基礎知識 大阪大学 篠原研究室




補足説明 2 元素記号を用いた原子核の表し方 公益財団法人 日本分析センター Japan Chemical Analysis Center



元素 Wikipedia



原子とは コトバンク




周期表 元素記号の関連化学用語をまとめて解説




定期テスト等では 原子番号は提示されないけど 質量数は提示されますよね Clear




質量数とは 求め方と原子番号との関係をまとめてみた 化学受験テクニック塾



Www Oit Ac Jp Is Shinkai Nishinomiya 15 Shinkai Slide9 Pdf



Over The 311 フクシマを超えて



急ぎです ワードで 元素記号の左側に原子番号と質量数をバランスよ Yahoo 知恵袋



原子の表し方で 原子記号の左上に付いている数字は 質量数 陽子 Yahoo 知恵袋



金箔にa線を照射して 通過するa線の軌跡を調べた ラザフォードの実験 ほとんどのa線は通過 小さい確率ながら跳ね返ったり Ppt Download



Ten Tokyo Shoseki Co Jp Spl Hl Support Files Kou E6 94 B9 E8 A8 E5 8c 96 E5 Ad A6 E5 9f Ba E7 8e 1 E7 A E7 Ab A0 E5 8e 9f E5 Ad 90 81 Ae E6 8b E9 80 A0 81 A8 E5 85 E7 B4 A0 81 Ae E5 91 A8 E6 9c 9f E8 A1 A8 Pdf




質量数とは 求め方 みんなが知りたい2つの疑問を解消 高校生向け受験応援メディア 受験のミカタ




小型の元素周期表



1




原子の質量数と同位体 アイソトープ



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Kiso Mass Number




第2回 我々が見つけた 113番元素はここですね ナショナルジオグラフィック日本版サイト



原子核と核反応 03 06 01 03 Atomica




L4l C 1 See How To Solve It At Qanda



Http Blog Livedoor Jp Yoshi S3 Archives Html




原子の構造 原子番号と質量数の関係 Dr あゆみの物理教室



受験基礎化学 5 元素記号と同位体 みかみの参考書ブログ



原子とその構造 化学コラム



環境省 原子の構造と周期律




Signal 化学基礎 ある元素が どれくらいの重さの原子か を分かるようにするときは 元素記号の左上に 質量数 をメモできます 電子の質量はとっても小さいので無視し 陽子と中性子の合計数で表現することになっています 左下の 原子番号 は陽子




0 See How To Solve It At Qanda




同位体とは 同素体との違い 覚え方も早稲田生が紹介 高校生向け受験応援メディア 受験のミカタ



知識ゼロからわかる 超解説 科学用語 同位体 理化学ラボーブログ



原子とその構造



基礎化学




Web教材イラスト図版工房 R Ch 物質の基本構成 08




Periodex Chromeアプリ 元素記号や日本語の元素名を確認できる周期表アプリ Chrome拡張のいいところ



化学基礎 原子の構造 原子番号 質量数 Tekibo




原子 Chemihack おうちで学べる化学




人工元素 はどんな元素 科学館職員がわかりやすく解説 Study Z ドラゴン桜と学ぶwebマガジン




原子核で元素を読み解く 小林良彦のブログ




質量数とは 求め方 みんなが知りたい2つの疑問を解消 高校生向け受験応援メディア 受験のミカタ



物質構造の基本 原子と分子 単体と化合物 ふかラボ



Www Env Go Jp Chemi Rhm H30kisoshiryo Attach H30kiso Slide01 02 Pdf




福島第一原発 ヨウ素131 セシウム137とは ナンでもカンでも好奇心 Tomamのブログ



国際周期表年19にちなんで F フッ素 のお話 トピックス ヒカリラボ Photonてらす




原子の構造と原子番号と電子数および質量数



プルトニウムとは コトバンク



Q Tbn And9gcrlao1ib55oqv4lnss00rjmw0yuu6lvtspqzwgl19i3p6wnb J8 Usqp Cau




原子の構造 原子番号と質量数の関係 Dr あゆみの物理教室
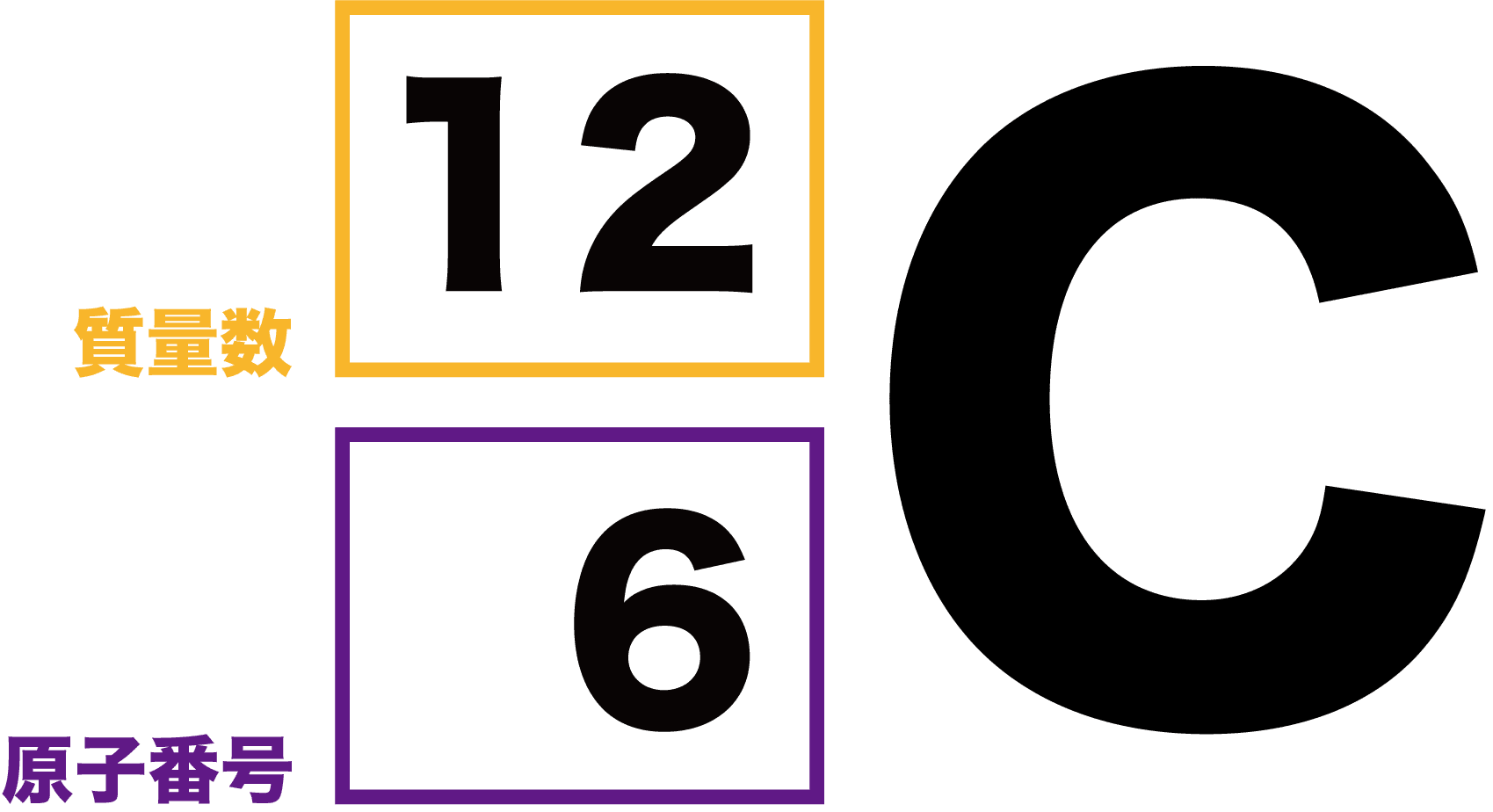



原子の構造 陽子 中性子 電子 原子核 質量数 原子番号の数と関係 化学のグルメ




原子核の内部構造 高校物理をあきらめる前に 高校物理をあきらめる前に




元素の英語名と読み方一覧表 発音記号とカタカナ読み方付き Yattoke 小 中学生の学習サイト




放射線の基礎 Riとは何か 長崎大学アイソトープ実験施設


コメント
コメントを投稿